Exercícios sobre a relação entre Lei de Avogadro e gases
Estes exercícios sobre a relação entre Lei de Avogadro e gases abordam a forma como as variáveis de estado do gás podem modificar sua quantidade molar.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
A Tabela a seguir apresenta os valores de temperatura, pressão e volume para cinco gases diferentes, contidos em recipientes separados e fechados:
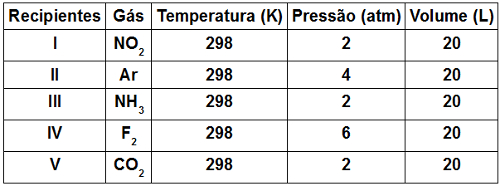
Baseando-se na lei de Avogadro, em qual dos recipientes existe um maior número de moléculas?
a) 1
b) 2
c) 3
d) 4
e) 5
Letra d). De acordo com Avogadro, volumes iguais de gases diferentes, submetidos a mesma pressão e temperatura, sempre apresentam o mesmo número de moléculas. Logo, se a temperatura e o volume forem iguais, terá o maior número de moléculas aquele recipiente com maior pressão, como é o caso do recipiente IV.
-
Questão 2
Segundo o italiano Lorenzo Romano Amedeo Carlo Avogadro , “quando dois ou mais gases estão ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, apresentam sempre o mesmo número de moléculas”. Baseado na afirmação proposta por ele, temos a seguir alguns recipientes fechados contendo gases, submetidos a uma mesma temperatura e pressão:
.jpg)
Em qual dos recipientes há um maior número de átomos de oxigênio e hidrogênio, respectivamente?
a) I e III
b) I e IV
c) II e III
d) II e IV
Letra d). Como o enunciado não informa as condições de temperatura e pressão em que os recipientes estão sendo submetidos, para determinar em quais recipientes existe a maior quantidade de átomos de oxigênio e hidrogênio, será necessária a realização de uma relação entre o volume molar e a constante de avogadro.
-
Para o recipiente I:
1 mol de NO2 corresponde a 22,4 L -------- que possui 2.6.1023 átomos de oxigênio
30 L de NO2 -------------------- x
22,4.x = 30.2.6.1023
x = 360.1023
22,4x = 16,07.1023 átomos de oxigênio
-
Para o recipiente II:
1 mol de NO corresponde a 22,4 L -------- que possui 1.6.1023 átomos de oxigênio
75 L de NO2 -------------------- x
22,4.x = 30.2.6.1023
x = 450.1023
22,4x = 20,01.1023 átomos de oxigênio
-
Para o recipiente III:
1 mol de NH3 corresponde a 22,4 L -------- que possui 3.6.1023 átomos de hidrogênio
30 L de NO2 -------------------- x
22,4.x = 30.2.6.1023
x = 540.1023
22,4x = 24,10.1023 átomos de hidrogênio
-
Para o recipiente IV:
1 mol de H2 corresponde a 22,4 L -------- que possui 2.6.1023 átomos de hidrogênio
90 L de NO2 -------------------- x
22,4.x = 30.3.6.1023
x = 540.1023
22,4x = 48,21.1023 átomos de hidrogênio
-
-
Questão 3
(Mackenzie-SP) Considerando dois gases com comportamento ideal, CH4 e C2H6, contidos em compartimentos separados e fechados, ambos com volumes iguais a 10 L, sob as mesmas condições de temperatura e pressão, de acordo com a hipótese de Avogadro, pode-se afirmar que ambos os gases:
a) contêm a mesma quantidade de moléculas.
b) possuem a mesma massa.
c) possuem a mesma massa molar.
d) contêm, respectivamente, 2 e 5 mols.
e) possuem iguais velocidades de difusão.
Letra a). De acordo com Avogadro, volumes iguais de gases diferentes, submetidos a mesma pressão e temperatura, sempre apresentam o mesmo número de moléculas.
-
Questão 4
(Ufla-MG) Segundo Avogadro, volumes iguais de gases quaisquer, na mesma pressão e temperatura, contêm igual número de moléculas. Considerando a seguinte reação:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Assinale a alternativa que indica corretamente o volume (em mL) de NH3, NO e H2O, respectivamente, sabendo‐se que o volume de O2 consumido foi de 100 mL.
a) 80, 80, 120
b) 100, 100, 100
c) 160, 80, 180
d) 40, 40, 120
Letra a). O enunciado informa que os gases estão submetidos a mesma pressão e temperatura, logo, o que irá determinar a quantidade de moléculas é o volume que eles apresentam. Como o exercício informou apenas o volume do gás O2, 100mL, podemos determinar o volume dos outros participantes pela proporção em mol, como expressado a seguir:
-
Para o NH3:
5 mol de O2(g) ---- 100 mL
4 mol NH3(g) ------ x
5x = 4.100
x = 400
5x = 80 mL de NH3
-
Para o NO(g):
5 mol de O2(g) ---- 100 mL
4 mol NO(g)------ x
5x = 4.100
x = 400
5x = 80 mL de NO
-
Para o H2O:
5 mol de O2(g) ---- 100 mL
6 mol H2O(g) ------ x
5x = 6.100
x = 600
5x = 120 mL de H2O
-
