Exercícios sobre moléculas orgânicas polares ou apolares
Com estes exercícios sobre as moléculas orgânicas polares e apolares, é possível avaliar o que você sabe dos critérios de classificação dos compostos quanto à polaridade.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Em um laboratório, um estudante de Química necessitava armazenar alguns metais alcalinos (por exemplo, sódio, lítio e potássio) em recipientes sem a presença de ar atmosférico, já que esses metais reagem intensamente com a água em qualquer estado físico. Sabendo que a água é um solvente polar, em qual dos líquidos a seguir o estudante poderia armazenar os metais alcalinos sem riscos de explosão?
a) acetona
b) querosene
c) metóxi-metano
d) etanol
e) ácido acético
Letra b). Como o metal alcalino reage intensamente com a água, isso pode acontecer em qualquer solvente polar. Em razão disso, o estudante deve armazenar o metal em um solvente apolar. Entre as opções fornecidas:
a- A acetona é a propanona, ou seja, uma cetona com três átomos de carbono. Quanto menor a cetona, maior a sua polaridade.
b- Querosene é um hidrocarboneto obtido na destilação do petróleo, e todo hidrocarboneto é apolar.
c- Metóxi-metano é um éter com dois carbonos. Quanto menor o éter, maior a sua polaridade.
d- Etanol é um álcool com dois carbonos. Quanto menor o álcool, maior a sua polaridade.
e- Ácido acético é um ácido carboxílico com dois carbonos. Quanto menor o álcool, maior a sua polaridade.
-
Questão 2
Quando realizamos a comparação entre os pontos de ebulição de compostos orgânicos, levamos em consideração as forças que unem as suas moléculas, as quais tem uma relação direta com a característica polar ou apolar do composto. Assim, comparando os compostos:
I) etanol
II) etanal
III) éter isopropil isobutílico
IV) propano
Quais deles são polares?
a) I e III
b) I e II
c) II e III
d) I e IV
e) III e IV
Letra b). A alternativa b contém os compostos polares, porque:
I- Etanol é um álcool com dois carbonos. Quanto menor o álcool, maior a sua polaridade.
II- Etanal é um aldeído com dois carbonos. Quanto menor o aldeído, maior a sua polaridade.
III- Éter isopropil isobutílico é um éter que apresenta sete átomos de carbono na cadeia. Quanto maior o éter, menor a sua polaridade, portanto a molécula tende a ser apolar.
IV- Propano é um alcano, ou seja, um hidrocarboneto, e toda substância dessa função orgânica é considerada apolar.
-
Questão 3
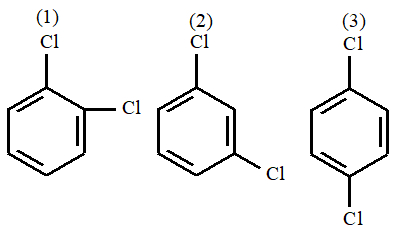
(Unesp-SP) Existem três compostos diclorobenzeno diferentes de fórmula molecular C6H4Cl2, que diferem em relação às posições dos átomos de cloro no anel benzênico, conforme as figuras 1, 2 e 3.
Das três figuras, é polar a fórmula apresentada em:
a) 3, somente.
b) 1 e 2, somente.
c) 1 e 3, somente.
d) 2 e 3, somente.
e) 1, 2 e 3.
Letra b). Há três haletos orgânicos diferentes nesse exercício, sendo que esses compostos tendem a apresentar polaridade, porém essa tendência diminui quando há mais de um halogênio na molécula.
Por causa disso, para determinar se a molécula é polar ou apolar, devemos analisar o vetor momento dipolar resultante da molécula, que é dado pelos vetores presentes nela:
-
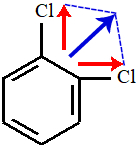
Estrutura I:
Na estrutura I, temos dois vetores perpendiculares (setas vermelhas), logo devemos decompô-los em um único vetor (azul). Como na estrutura há apenas um vetor, o vetor momento dipolar resultante é diferente de zero, o que carateriza a molécula como polar.
-
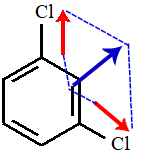
Estrutura II
Na estrutura II, há dois vetores perpendiculares (setas vermelhas), logo devemos decompô-los em um único vetor (azul). Como na estrutura há apenas um vetor, o vetor momento dipolar resultante é diferente de zero, o que carateriza a molécula como polar.
-
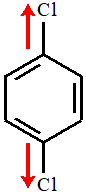
Estrutura III: Apresenta um vetor direcionado para cima e um vetor direcionado para baixo, por isso um anula o outro. Assim, o vetor momento dipolar resultante é igual a zero, o que caracteriza molécula apolar.
-
-
Questão 4
(Unesp-SP) A polaridade de substâncias orgânicas é consequência tanto da geometria molecular quanto da polaridade das ligações químicas presentes na molécula. Indique a alternativa que contém apenas substâncias apolares.
a) Acetileno e álcool etílico.
b) Álcool etílico e etano.
c) Tetracloreto de carbono e etano.
d) Metano e cloreto de metila.
e) Tetracloreto de carbono e cloreto de metila.
Letra c). A alternativa C apresenta apenas moléculas apolares, pois:
-
Tetracloreto de carbono (CCl4) é um composto que apresenta geometria tetraédrica e quatro ligantes iguais, o que indica molécula apolar.
-
Etano é uma substância que pertence à função orgânica dos hidrocarbonetos, e todo composto dessa função é apolar.
-
Metano é uma substância que pertence à função orgânica dos hidrocarbonetos, e todo composto dessa função é apolar.
-
Cloreto de metila é um haleto orgânico com apenas dois carbonos, e todo haleto de cadeia pequena é polar.
-
Álcool etílico é o etanol, um álcool com dois carbonos. Quanto menor o álcool, maior a sua polaridade.
-
Acetileno é nome usual do etino, uma substância que pertence à função orgânica dos hidrocarbonetos, e todo composto dessa função é apolar.
-